أدخل كلمة أو عبارة بأي لغة 👆
اللغة:
ترجمة وتحليل الكلمات عن طريق الذكاء الاصطناعي ChatGPT
في هذه الصفحة يمكنك الحصول على تحليل مفصل لكلمة أو عبارة باستخدام أفضل تقنيات الذكاء الاصطناعي المتوفرة اليوم:
- كيف يتم استخدام الكلمة في اللغة
- تردد الكلمة
- ما إذا كانت الكلمة تستخدم في كثير من الأحيان في اللغة المنطوقة أو المكتوبة
- خيارات الترجمة إلى الروسية أو الإسبانية، على التوالي
- أمثلة على استخدام الكلمة (عدة عبارات مع الترجمة)
- أصل الكلمة
%ما هو (من)٪ 1 - تعريف
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 53
Йод; Раствор йода; Раствор иода
ИОД
I (iodum), неметаллический химический элемент VIIА подгруппы периодической системы элементов, член семейства галогенов: F, Cl, Br, I, At. В 1811 Б.Куртуа, обрабатывая горячей серной кислотой сильнощелочной раствор, полученный из золы морских водорослей и используемый в производстве селитры, получил фиолетовые пары, которые при конденсации превратились в серые кристаллы. Независимо от него в 1813Х.Дэви и Ж.Гей-Люссак получили такие же кристаллы и установили элементную природу их, предложив название иод (от греческого слова, означающего "фиалкоподобный"). Иод наиболее известен в форме спиртовой настойки, используемой как антисептик. В свободном виде иод в природе не встречается, но его соединения широко распространены. Иодиды присутствуют в малых количествах в морской воде и морских водорослях, а иод входит в состав тироксина - гормона щитовидной железы. Главным промышленным источником иода являются природные газы из скважин с рассолами в Японии, отложения натриевой селитры в Чили, в которых иод присутствует в виде примеси иодата кальция, и в США в буровых водах Оклахомы и богатых минеральных источниках Мичигана.
Иодометрия. Важнейшим применением иода является метод количественного химического анализа, называемый иодометрией. Иодометрия основана на том, что иод окисляет многие вещества. Для определения количества вещества в растворе к нему добавляют заданное количество раствора иода, иод восстанавливается до иодида и окраска раствора исчезает. По количеству иода, необходимого для окисления вещества, определяют количество вещества в растворе. В другом способе к иодиду добавляют окислитель и определяют количество выделившегося иода.
Свойства. Иод - блестящее серое кристаллическое вещество ромбической структуры. Возгоняется при нагревании, образуя фиолетовые пары, состоящие из двухатомных молекул I2. Хотя иод плохо растворим в воде, он растворим в растворах иодидов благодаря образованию трииодид-иона I3-. Иод образует интенсивный коричневый раствор в спирте и фиолетовый в хлороформе и дисульфиде углерода. Крахмал в присутствии иода окрашивается в глубокий синий цвет, что используется как тест на иод. В ряду активности иод стоит после фтора, хлора и брома, и эти элементы вытесняют его из растворов иодидов. Фтор, хлор и бром соединяются непосредственно с иодом, образуя межгалогенные соединения, например IF7, ICl, IBr. Иод соединяется со всеми металлами, кроме благородных (например, Pt и Au), и образует иодиды типа NaI. Он соединяется с неметаллами, но не реагирует с кислородом, хотя известны оксиды иода, IO2 и I2O4 (диоксид), I2O5 (пентаоксид) и I2O3 (триоксид), который чрезвычайно неустойчив. I2O5 образуется при нагревании иодноватой кислоты.
Соединения. Иодоводород HI получают гидролизом PI3 (иодид фосфора). Реакцию проводят, добавляя воду к смеси красного фосфора и иода. Иодоводород - бесцветный газ с резким запахом, образует пары во влажной среде и легко растворяется в воде. Водный раствор называется иодоводородной кислотой; это сильная коррозионно-активная кислота, являющаяся мощным восстановителем. Иодиды некоторых металлов имеют характерную окраску, например, иодид свинца PbI2 светложелтый, а иодид ртути HgI2 алый.
Оксокислоты. Известны некоторые оксокислоты иода; они являются сильными окислителями. Иодноватистая кислота HIO очень неустойчива и разлагается на свободный иод и иодат-ион IO3-. Иодистая кислота HIO2 существует только в момент образования и разлагается; иодноватая кислота HIO3 - белое твердое вещество, хорошо растворимое в воде, ее получают при взаимодействии иода с HClO, HClO2 или с пероксидом водорода в кислой среде. Соли этой кислоты называются иодатами. Иодная кислота HIO4 - наиболее сильный окислитель из всех оксокислот галогенов. Она существует в форме гидрата HIO4?2H2O, т.е. H5IO6. Соли этой кислоты называются периодатами, они также являются сильными окислителями в кислой среде. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
Применение. Применяемая в медицине настойка иода, т.е. раствор 2% элементного иода и 2,5% иодида натрия в спирте, широко используется как антисептик для порезов и царапин. Иод важен для нормального функционирования щитовидной железы, поэтому поваренная соль с добавками иодида натрия или иодида калия является важным диетическим компонентом. Иногда иодид калия принимают для лечения зоба, который вызывается дефицитом иода в щитовидной железе. Иодоформ CHI3 применяют для дезинфекции одежды, так как он медленно выделяет свободный иод. В промышленности иод применяют для изготовления анилиновых красителей. Иодид серебра иногда используют в фотографии.
иод
| Спиртовая настойка на этом веществе - тинктура иода, применяемая в медицине как средство, дезинфицирующее или способствующее рассасыванию при воспалительных процессах.
Иод
(лат. Iodum)
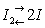
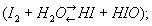
I, химический элемент VII группы периодической системы Менделеева, относится к галогенам (См. Галогены) (в литературе встречается также символ J); атомный номер 53, атомная масса 126,9045; кристаллы черно-серого цвета с металлическим блеском. Природный И. состоит из одного стабильного изотопа с массовым числом 127. И. открыл в 1811 французский химик Б. Куртуа. Нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой, он наблюдал выделение фиолетового пара (отсюда назв. И. - от греч. iódes, ioeidés - похожий цветом на фиалку, фиолетовый), который конденсировался в виде тёмных блестящих пластинчатых кристаллов. В 1813-1814 французский химик Ж. Л. Гей-Люссак и английский химик Г. Дэви доказали элементарную природу И.
Распространение в природе. Среднее содержание И. в земной коре 4․10-5\% по массе. В мантии и магмах и в образовавшихся из них породах (гранитах, базальтах и др.) соединения И. рассеяны; глубинные минералы И. неизвестны. История И. в земной коре тесно связана с живым веществом и биогенной миграцией. В биосфере наблюдаются процессы его концентрации, особенно морскими организмами (водорослями, губками и др.). Известны 8 гипергенных минералов И., образующихся в биосфере, однако они очень редки. Основным резервуаром И. для биосферы служит Мировой океан (в 1 л в среднем содержится 5․10-5 г И.). Из океана соединения И., растворённые в каплях морской воды, попадают в атмосферу и переносятся ветрами на континенты. (Местности, удалённые от океана или отгороженные от морских ветров горами, обеднены И.) И. легко адсорбируется органическими веществами почв и морских илов. При уплотнении этих илов и образовании осадочных горных пород происходит десо́рбция, часть соединений И. переходит в подземные воды. Так образуются используемые для добычи И. иодо-бромные воды, особенно характерные для районов нефтяных месторождений (местами 1 л этих вод содержит свыше 100 мг И.).
Физические и химические свойства. Плотность И. 4,94 г/см3, tпл 113,5 °С, tкип 184,35 °C. Молекула жидкого и газообразного И. состоит из двух атомов (I2). Заметная диссоциация
наблюдается выше 700°С, а также при действии света. Уже при обычной температуре И. испаряется, образуя резко пахнущий фиолетовый пар. При слабом нагревании И. возгоняется, оседая в виде блестящих тонких пластинок; этот процесс служит для очистки И. в лабораториях и в промышленности. И. плохо растворим в воде (0,33 г/л при 25 °С), хорошо - в сероуглероде и органических растворителях (бензоле, спирте и др.), а также в водных растворах иодидов.
Конфигурация внешних электронов Атома И. 52s 55p. В соответствии с этим И. проявляет в соединениях переменную валентность (степень окисления): - 1 (в HI, KI, см. Иодистый водород, Иодиды), + 1 (в HIO, KIO, см. Иодноватистая кислота), + 3 (в ICl3, см. Межгалогенные соединения), + 5 (в HIO3, KIO3, см. Иодноватая кислота) и + 7 (в HIO4, KIO4, см. Иодная кислота). Химически И. довольно активен, хотя и в меньшей степени, чем Хлор и Бром. С металлами И. при лёгком нагревании энергично взаимодействует, образуя иодиды (Hg + I2 = HgI2). С водородом И. реагирует только при нагревании и не полностью, образуя иодистый водород. С углеродом, азотом, кислородом И. непосредственно не соединяется. Элементарный И. - окислитель, менее сильный, чем хлор и бром. Сероводород H2S, тиосульфат натрия Na2S2O3 и др. восстановители восстанавливают его до I-(I2 + H2S = S + 2HI). Хлор и другие сильные окислители в водных растворах переводят его в IO3-(5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl). При растворении в воде И. частично реагирует с ней
в горячих водных растворах щелочей образуются иодид и иодат (3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O). Адсорбируясь на крахмале, И. окрашивает его в тёмно-синий цвет; это используется в иодометрии и качественном анализе для обнаружения И.
Пары И. ядовиты и раздражают слизистые оболочки. На кожу И. оказывает прижигающее и обеззараживающее действие. Пятна от И. смывают растворами соды или тиосульфата натрия.
Получение и применение. Сырьём для промышленного получения И. в СССР служат нефтяные буровые воды; за рубежом - морские водоросли, а также маточные растворы чилийской (натриевой) селитры, содержащие до 0,4\% И. в виде иодата натрия. Для извлечения И. из нефтяных вод (содержащих обычно 20-40 мг/л И. в виде иодилов) на них сначала действуют хлором (2NaI + Cl2 = 2NaCl + I2) или азотистой кислотой (2NaI + 2NaNO2 + 2H2SO4 = 2Na2SO4 + 2NO + I2 + 2H2O). Выделившийся И. либо адсорбируют активным углём, либо выдувают воздухом. На И., адсорбированный углём, действуют едкой щёлочью или сульфитом натрия (I2 + Na2SO3 + H2O = Na2SO4 + 2HI). Из продуктов реакции свободный И. выделяют действием хлора или серной кислоты и окислителя, например дихромата калия (K2Cr2O7 + 7H2SO4 + 6NaI = K2SO4 + 3Na2SO4 + Cr2(SO4)3 + 3I2). При выдувании воздухом И. поглощают смесью двуокиси серы с водяным паром (2H2O + SO2 + I2 = = H2SO4 + 2HI) и затем вытесняют И. хлором (2HI + Cl2 = 2HCl + I2). Сырой кристаллический И. очищают возгонкой.
И. и его соединения применяют главным образом в медицине и в аналитической химии (см. Иодометрия), а также в органическом синтезе и фотографии. В промышленности применение И. пока незначительно по объёму, но весьма перспективно. Так, на термическом разложении иодидов основано получение высокочистых металлов (см. Иодидный метод).
Лит.: Ксензенко В. И., Стасиневич Д. С., Технология брома и иода, М., 1960; Позин М. Е., Технология минеральных солей, 3 изд., Л., 1970, гл. 8; Ролстен Р. Ф., Иодидные металлы и иодиды металлов, пер. с англ., М., 1968.
Д. С. Стасиневич.
Иод в организме. И. - необходимый для животных и человека микроэлемент (См. Микроэлементы). В почвах и растениях таёжно-лесной нечернозёмной, сухостепной, пустынной и горных биогеохимических зон И. содержится в недостаточном количестве или не сбалансирован с некоторыми другими микроэлементами (Со, Mn, Cu); с этим связано распространение в этих зонах эндемического зоба. Среднее содержание И. в почвах около 3․10-4\%, в растениях около 2․10-5 \%. В поверхностных питьевых водах И. мало (от 10-7 до 10-9\%). В приморских областях количество И. в 1 м3 воздуха может достигать 50 мкг, в континентальных и горных - составляет 1 или даже 0,2 мкг.
Поглощение И. растениями зависит от содержания в почвах его соединений и от вида растений. Некоторые организмы (так называемые концентраторы И.), например морские водоросли - фукус, ламинария, филлофора, накапливают до 1\% И., некоторые губки - до 8,5\% (в скелетном веществе спонгине). Водоросли, концентрирующие И., используются для его промышленного получения. В животный организм И. поступает с пищей, водой, воздухом. Основной источник И. - растительные продукты и корма. Всасывание И. происходит в передних отделах тонкого кишечника. В организме человека накапливается от 20 до 50 мг И., в том числе в мышцах около 10-25 мг, в щитовидной железе в норме 6-15 мг. С помощью радиоактивного И. (131I и 125I) показано, что в щитовидной железе И. накапливается в митохондриях эпителиальных клеток и входит в состав образующихся в них дииод- и моноиодтирозинов, которые конденсируются в гормон тетраиодтиронин (Тироксин). Выделяется И. из организма преимущественно через почки (до 70-80\% ), молочные, слюнные и потовые железы, частично с жёлчью.
В различных биогеохимических провинциях (См. Биогеохимические провинции) содержание И. в суточном рационе колеблется (для человека от 20 до 240 мкг, для овцы от 20 до 400 мкг). Потребность животного в И. зависит от его физиологического состояния, времени года, температуры, адаптации организма к содержанию И. в среде. Суточная потребность в И. человека и животных - около 3 мкг на 1 кг массы (возрастает при беременности, усиленном росте, охлаждении). Введение в организм И. повышает основной обмен, усиливает окислительные процессы, тонизирует мышцы, стимулирует половую функцию.
В связи с большим или меньшим недостатком И. в пище и воде применяют иодирование поваренной соли, содержащей обычно 10-25 г иодистого калия на 1 т соли. Применение удобрений, содержащих И., может удвоить и утроить его содержание в с.-х. культурах.
Лит.: Гутбертсон Д. П., Микроэлементы, в кн.: Новое в физиологии домашних животных, пер. с англ., т. 1, М.-Л., 1958; Туракулов Я. Х., Биохимия и патохимия щитовидной железы, Таш., 1963; Берзин Т., Биохимия гормонов, пер. с нем., М., 1964; Рапопорт С. М., Медицинская биохимия, пер. с нем., М., 1966.
В. В. Ковальский.
Иод в медицине. Препараты, содержащие И., обладают антибактериальными и противогрибковыми свойствами, она оказывают также противовоспалительное и отвлекающее действие; их применяют наружно для обеззараживания ран, подготовки операционного поля. При приёме внутрь препараты И. оказывают влияние на обмен веществ, усиливают функцию щитовидной железы. Малые дозы И. (микроиод) тормозят функцию щитовидной железы, действуя на образование тиреотропного гормона передних долей гипофиза. Поскольку И. влияет на белковый и жировой (липидный) обмен, он нашёл применение при лечении атеросклероза, так как снижает содержание холестерина в крови; повышает также фибринолитическую активность крови.
Для диагностических целей используют рентгеноконтрастные вещества, содержащие И.
При длительном применении препаратов И. и при повышенной чувствительности к ним возможно появление иодизма - насморк, крапивница, отёк Квинке, слюно- и слезотечение, угревидная сыпь (иододерма) и пр. Препараты И. нельзя принимать при туберкулёзе лёгких, беременности, при заболеваниях почек, хронической пиодермии, геморрагических диатезах, крапивнице.
Иод радиоактивный. Искусственно радиоактивные изотопы И. - 125I, 131I, 132I, и др. широко используются в биологии и особенно в медицине для определения функционального состояния щитовидной железы и лечения ряда её заболеваний. Применение радиоактивного И. в диагностике связано со способностью И. избирательно накапливаться в щитовидной железе; использование в лечебных целях основано на способности β-излучения радиоизотопов И. разрушать секреторные клетки железы. При загрязнениях окружающей среды продуктами ядерного деления радиоактивные изотопы И. быстро включаются в биологический круговорот, попадая, в конечном счёте, в молоко и, следовательно, в организм человека. Особенно опасно их проникновение в организм детей, щитовидная железа которых в 10 раз меньше, чем у взрослых людей, и к тому же обладает большей радиочувствительностью. С целью уменьшения отложения радиоактивных изотопов И. в щитовидной железе рекомендуется применять препараты стабильного И. (по 100-200 мг на приём). Радиоактивный И. быстро и полностью всасывается в желудочно-кишечном тракте и избирательно откладывается в щитовидной железе. Его поглощение зависит от функционального состояния железы. Относительно высокие концентрации радиоизотопов И. обнаруживаются также в слюнных и молочной железах и слизистой желудочно-кишечного тракта. Не поглощённый щитовидной железой радиоактивный И. почти полностью и сравнительно быстро выделяется с мочой.
Ю. И. Москалев.
ويكيبيديا
Иод

Ио́д (общеупотребительное название — йо́д; от греч. ἰώδης — «фиалковый (фиолетовый)», также от лат. Iodum) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53.
Простое вещество иод (при нормальных условиях) — это кристаллы (формула — I2) чёрно-серого цвета с фиолетовым металлическим блеском, проявляющие неметаллические свойства и издающие характерный запах. Легко образует фиолетовые пары, обладающие резким запахом. Элементарный иод высокотоксичен.
أمثلة من مجموعة نصية لـ٪ 1
1. В числе лидеров - нитроглицерин, иод, аспирин и анальгин отечественного производства.
2. В последние годы Иод Заумович все чаще откладывает скальпель и берется за перо.
3. Погасить коварный йододефицит можно, например, с помощью йодосодержащего препарата нового поколения - "Иод-Актив". Запомните это название!
4. В частности, предприятие выпускает столь востребованные в наших аптеках биодобавки, как "Капилар", "Виардо", "Артро- Актив", "Иод-Актив" и т. д.
5. Сербского, где Иод Заумович провел несколько долгих лет, пройдя нелегкий путь от простого буйного пациента до руководителя.






![возгонку]]), а не на повышение температуры твёрдой фазы, иод, не плавясь, возгоняется и превращается сразу в пары. Наоборот, при охлаждении иод десублимируется и образует кристаллы, минуя жидкое состояние. Для превращения в жидкость твёрдый иод нагревают в закрытом сосуде. При очень быстром (нестатическом) нагреве иод плавится даже в открытом сосуде возгонку]]), а не на повышение температуры твёрдой фазы, иод, не плавясь, возгоняется и превращается сразу в пары. Наоборот, при охлаждении иод десублимируется и образует кристаллы, минуя жидкое состояние. Для превращения в жидкость твёрдый иод нагревают в закрытом сосуде. При очень быстром (нестатическом) нагреве иод плавится даже в открытом сосуде](https://commons.wikimedia.org/wiki/Special:FilePath/Phase diagram of iodine.png?width=200)
